| ��R�ҁ@���@����
��P�́@�T�^���f
|
|
1���f�����\�@2���f�@3�M�K�X�@�@
4�n���Q���@5�_�f�Ɨ����@
6���f�ƃ����@7�Y�f�ƃP�C�f�@8�C��
|
|
|
�P�@���f�̎�ނƎ����\�@
|
|
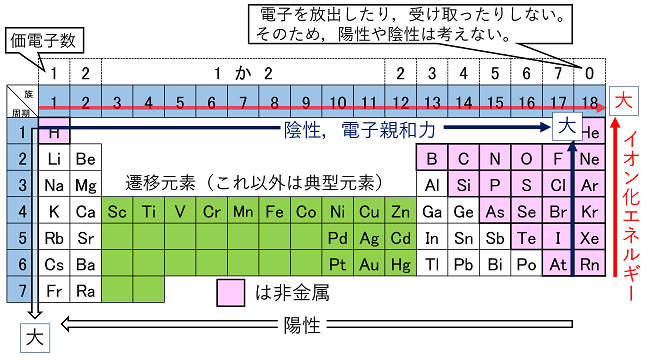
�����\�̉��̕��т��k�@�����@�l�C�c�̕��т��k�@���@�l�Ƃ����B���̕��т͌��q�ԍ��̏��ɂȂ��Ă���B�������̌��f�́k�@�������f�@�l�ƌĂ�C���d�q���������i�ŊO�k�d�q���������j�Ȃ̂ŁC���������Ă����C���ꂼ��̑���1�̃O���[�v�ɂȂ��Ă���i3���`12���͗�O�j�B���̂��߁C�c�̏��ԂŊo���邱�Ƃ��d�v�B����1,2,17,18���ɂ͂��ꂼ��k�@�A���J�������@�l�C�k�@�A���J���y�ދ����@�l�C�k�@�n���Q���@�l�C�k�@�M�K�X�@�l�Ƃ������O�i�O���[�v���j�����Ă���B���̎����\�œ�d���ň͂������k�@�J�ڌ��f�@�l�C����ȊO���k�@�T�^���f�@�l�Ƃ����B�܂��C�����ň͂����́C���ׂāC�k�@��������f�@�l�C����ȊO�́k�@�������f�@�l�ł���B
�@�A���J�������͍ŊO�k�̓d�q����o���C������̓d�q�k��d�q��8�ɂ��āC�z�C�I���ɂȂ�B���̐�����z���������Ƃ����B�A���J���������f���ł͌��q�ԍ����傫���Ȃ�قǁi�����\�ʼn��ɂ����قǁj�z���������Ȃ��@�B�܂��n���Q���͍ŊO�k�ɓd�q����荞�݁C�d�q����8�ɂ��āC�A�C�I���ɂȂ�B���̐������A���������Ƃ����B�n���Q�����f���ł͌��q�ԍ����������Ȃ�قǁi�����\�ŏ�ɂ����قǁj�A���������Ȃ��A�B�����\�ł�18�����������B�E��ɂ����قljA���������Ȃ�C�����ɂ����قǗz���������Ȃ�X��������B
|
|
 |
|
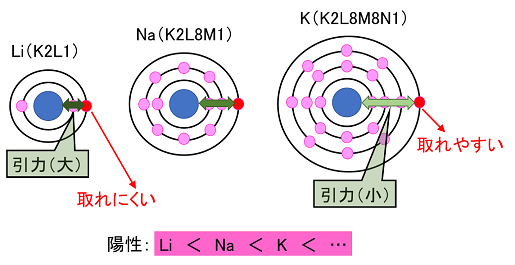
�@�@�A���J�������̓d�q�z�u�́CLi�iK2L1�j�CNa�iK2L8M1�j�CK�iK2L8M8N1�j�Ȃ̂ŁC�ŊO�k�ƌ��q�j�̋����́CLi��Na��K���c�ƂȂ�B���̋������������قǁC
���q�j�̈��͂��傫���Ȃ�̂œd�q�����ɂ����Ȃ�B�܂�C�d�q�̎��₷���i�z���̋����j�́CLi��Na��K���c�ƂȂ�B�i�����j
|
|
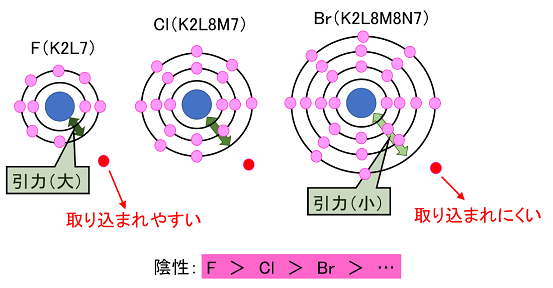 |
| �A�@�n���Q���̓d�q�z�u�́CF�iK2L7�jCl�iK2L8M7�j�CBr�iK2L8M18N7�j�Ȃ̂ŁC�ŊO�k�ƌ��q�j�̋����́CF��Cl��Br���c�ƂȂ�B���̋������������قnj��q�j�̈��͂��傫���Ȃ�̂ŁC��苭���ŊO�k�ɓd�q������邱�Ƃ��ł���B�܂�C�d�q�̎��₷���i�A���̋����j�́CF��Cl��Br���c�ƂȂ�B�i�E��j |
|
�B�@�M�K�X�̓d�q�z�u�͍ŊO�k���ő吔�Ŗ�������Ă���i�k�j��8�ň���Ȃ̂ŁC�d�q����o������C������肵�Ȃ��B���̂��߁C�z����A���͍l���Ȃ��B
|
|
�Q�@���f��
�y���f�̒P�̂̐��@�z
|
|
���fH�͉F���ōł��������݂��錳�f�ł���i�n���̒n�k�t�߂ł́CO��Si��Al��Fe�j�B�P�̂�H2�ŁC�A�����j�ANH3�C�������fHCl�C���^�m�[��CH3OH�̍����C�R���d�r�̊������C���P�b�g�̔R���Ȃǂɗ��p�����B
�i�H �� �I�j�Y�����f�Ɛ����C�@�@CH4
+ H2O �� CO + 3H2
�i�������I�j�@�����ȂǂɊ_��_
�k�@Zn �{ 2HCl�@���@ZnCl2�@�{�@H2�@�l�@�@�@�@�@�@�@�@�@�k�@Zn �{ H2SO4�@���@ZnSO4�@�{�@H2�@�l
�i���@���w�̔������@�p�^�[��3�@�����Ɖ��_�@�ˁ@���̋����̉��_���{���j�i���@���w�̔������@�p�^�[��4�@�����Ɨ��_�@�ˁ@���̋����̗��_���{���j
|
|
|
�y���f�̉������z
|
|
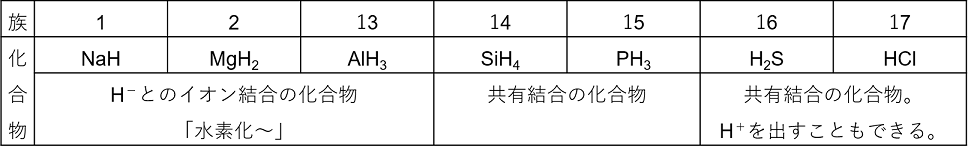
���f��Cl�CN�CC�Ȃǂ̔�����̌��f�Ƃ͋��L�������ĕ��q�����BHCl�ȂǁC���L�����łł����������̒��ɂ́C�d������H�{����o���镨���i�_�j������B�z���̋����i�z�C�I���ɂȂ�₷���j�����Ƃ�H�|�i���f�����C�I���j�Ƃ��ăC�I����������B
|
|
 |
|
�R�@�M�K�X���f�i18�����f�j��
|
|
�M�K�X���q�̍ŊO�k�ɓ����Ă���d�q�̐��́CHe�ł́k�@2�@�l�C���̌��f�͂��ׂāk�@8�@�l�ň��肵�Ă���C�C�I�����G�l���M�[�͂�����������B���̂��߁C���̌��q�ƌ��������肹���C���q1�̏�ԁi�P���q���q�Ƃ����j�ő��݂���B
He�́C�s�R���Ő��f�ɂ��Ōy���̂ŁC�C���E��s�D�ɗp������B�܂��C���_���ɂ߂ĒႢ�̂Œ��`���⒴�����Ȃǂ̋ɒቷ�̌����ɗp������BNe�́C�t�̋�C�̕����ɂ���ē����C�l�I���T�C��(�Ԟ�F)�Ɏg����BAr�͋M�K�X�̒��ŁC�ł���C���ɑ������݂���B�t�̋�C�̕����ɂ���ē����C�d���̕����K�X�C�n�ڂ�|�p�̕ی�K�X�i�_���h�~�K�X�j�ȂǂɎg����BKr���d���̕����K�X�ɗp������BXe���������d�ǂ͋���������̂ŁC�X�g���{�Ɏg����BRn�͕��ː�������C���Âɗp������B
|
|
 |